阿尔茨海默病(Alzheimer’s disease,AD)是在1906年首次由德国精神神经病学家爱罗斯·阿尔茨海默(Alois Alzheimer)发现,并以其名字命名的一种慢性神经退行性疾病,起病缓慢、隐匿,主要临床表现为记忆力逐渐减退、认知功能发生障碍、行为异常和社交障碍等。
《世界阿尔茨海默病2018年报告》显示,每3秒钟,全球就有一位痴呆症患者产生。全球目前至少有5000万痴呆患者。到2050年,这个数字预计将达到1.52亿,其中有约60%-70%为阿尔茨海默病患者。在我国,目前约有1000万阿尔茨海默病患者,预计到2050年患病人数将超过4000万。
AD药物的研发一直是个世界性的热点与难题。自2000年以来,美国药品研究与制造商协会(PhRMA)成员公司包括拜耳公司(Bayer Corporation)、礼来公司(Eli Lilly and Company)、葛兰素史克公司(GSK)、默沙东(Merck & Co., Inc.)、辉瑞(Pfizer Inc.)和其他33家公司已经在研发阿尔茨海默症的新药方面投资超过6000亿美元,仅2017年预估约投资714亿美元。
但几乎所有药物的研发均以失败告终:2018年5月,强生宣布终止BACE抑制剂atabecestat 的II/ III期项目;2018年6月,礼来和阿斯利康宣布终止治疗阿尔茨海默病的全球Ⅲ 期临床试验项目lanabecestat(BACE抑制剂);2019年1月,罗氏(Roche)宣布停止对阿尔茨海默病药物Crenezumab III期临床试验;2019年3月,美国百健(Biogen)公司联合日本卫材(Eisai)公司宣布终止β淀粉样蛋白抗体药物aducanumab的III期临床试验。
在1998-2017年期间,全球已有146个AD药物在临床中遭遇失败,仅有4种药物成功上市,这意味着每37种药物中只有1种药物能获得成功,即临床成功率仅为2.7%。
截至目前仅有6种阿尔茨海默病药物获得美国食品药品监督管理局(FDA)批准上市,分别为:1993年批准他克林;1996年批准多奈哌齐;2000年批准卡巴拉汀;2001年批准加兰他敏;2003年批准盐酸美金刚;2014年批准美金刚/多奈哌齐复方制剂),而所有这些药物都只是对症治疗,没有一种能够阻止或者逆转AD病情的进展。
阿尔茨海默病药物的研发失败并不是因为缺乏科学尝试,而是面临着多种独特的挑战,包括:AD诊断困难、临床前模型的局限性、缺乏有效的非侵入性生物标志物、开展临床试验方面的挑战,最重要的是,仍缺乏对AD确切机制的全面了解。
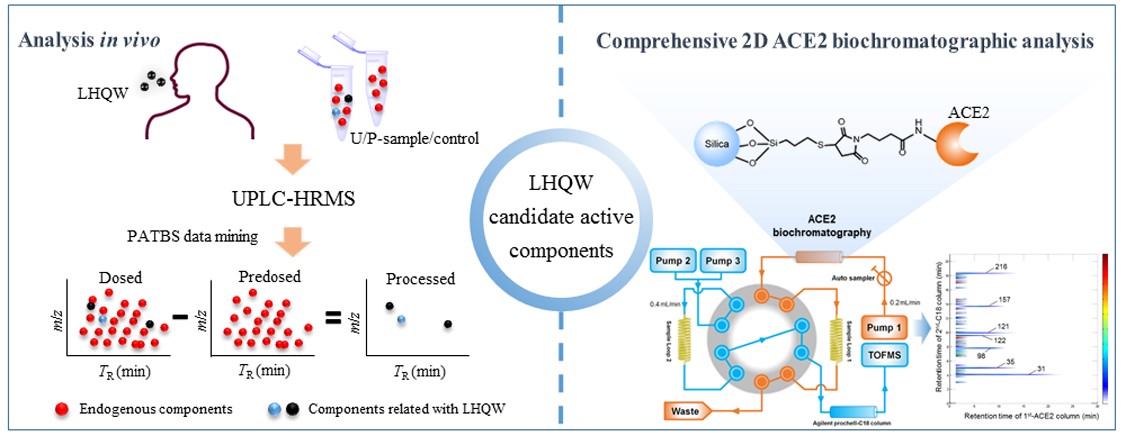
目前最有可能通过FDA审核的阿尔茨海默病新药之一是我国原创药物甘露特纳胶囊(九期一)。九期一由中科院上海药物研究所学术所长耿美玉教授课题组联合上海绿谷制药等研究团队研发,该药物是以海洋褐藻提取物为原料,制备获得的低分子酸性寡糖化合物。其作用机制研究表明,九期一®通过重塑肠道菌群平衡,抑制肠道菌群特定代谢产物的异常增多,减少外周及中枢炎症,降低β淀粉样蛋白沉积和Tau蛋白过度磷酸化,从而改善认知功能障碍。
2019年12月29日,九期一正式在国内上市,“用于轻度至中度阿尔茨海默病,改善患者认知功能”,这是自2003年以来全球第一个被批准的治疗阿尔茨海默病新药。2020年4月8日绿谷制药收到FDA正式文件通知,已批准原创治疗阿尔茨海默病新药甘露特钠胶囊(九期一)国际多中心Ⅲ期临床试验IND,批件自4月3日起正式生效。全部国际多中心Ⅲ期临床试验计划在2024年完成,在2025年完成新药注册申请。
该研究有望填补AD治疗领域内全世界17年没有新药上市的空白。尽管这一原创新药是否能为AD的治疗带来革命性的变化仍需药物进行国际多中心Ⅲ期临床试验后再予评价,但本研究的科研成果无疑大大增强了我们对AD药物研发的信心,并且为拓辟AD治疗新路径提供了翔实的实验依据。















.png)








